推荐一篇发表在PNAS上的文章,题目为“Lipid-derived electrophiles inhibit the function of membrane channels during ferroptosis”,通讯作者是来自加拿大麦吉尔大学的Gonzalo Cosa教授,研究兴趣为用光化学、光物理学以及有机化学的手段进行复杂体系的成像。
脂源性亲电小分子(lipid-derived electrophiles, LDEs),包括4-羟基壬烯醛(4-HNE),是铁死亡的重要生物标志物,但这些高活性物质在铁死亡细胞执行中的功能作用尚未确定。LDEs为α,β-不饱和醛或酮,主要与细胞中的半胱氨酸亲核试剂反应,因此可以改变蛋白质的性质,广泛的LDE烷基化会导致细胞功能的损伤。为了避免这种损伤,细胞通过两步反应进行LDEs的解毒:1)谷胱甘肽转移酶(GST)催化LDE与谷胱甘肽(GSH)偶联;2)MRP通道蛋白将该加合物转移至胞外。MRP蛋白在以往的研究中被发现可以被LDE烷基化以及被亲电试剂抑制,而该课题组此前开发过名为ElectrophileQ的方法用于活细胞LDE解毒过程的实时成像,因此,在本篇文章中,作者通过该方法研究了铁死亡过程中MRP通道蛋白被抑制的过程。

作者使用了一种与LDEs类似的可激活的荧光探针AcroB,该探针与GSH反应后产生荧光,并可以通过相同的LDEs解毒途径被转运出细胞外,从而使背景荧光信号增加。通过宽场荧光显微成像,作者通过细胞荧光信号与背景荧光信号来表征细胞执行LDEs解毒步骤的能力,并用L-丁硫氨酸亚砜胺(BSO)和ATP酶抑制剂正钒酸钠处理分别用于生成LDE解毒途径第一步或第二步抑制的标准曲线。

在本篇文章中,作者首先研究了该抑制过程在各种类型的铁死亡中是否具有普适性,并发现三种Ⅱ型的铁死亡诱导剂(ferroptosis inducers, FINs),RSL3, FINO2和FIN56都可以导致加合物转运过程的抑制。Ⅰ型FIN erastin绘制出的曲线在两种标准曲线之间,表明它可以抑制加合物的生成同时也会影响加合物转运的过程,是一个混合抑制的过程,作者通过PHOXN预孵育证明了抑制加合物转运的过程是依赖脂质过氧化的,并通过额外回补GSH证明了erastin引起的LDE加合物输出损伤与抑制MRP1活性期间观察到的结果一致,这证明了除了消耗GSH外erastin的其他作用对引起铁死亡也是至关重要的。

接下来,作者研究了铁死亡过程中加合物输出损伤的机制。作者通过依托泊苷抑制细胞分裂诱导细胞凋亡,观察到仅仅诱导细胞凋亡并不会引起输出功能的降低。作者用过氧化氢处理细胞,观察到一般ROS介导的氧化应激也可以导致输出损伤,但该损伤可以被PHOXN预孵育抑制,进一步表明脂质过氧化,而不仅仅是细胞ROS生成,是铁死亡期间LDE加合物输出损伤所必需的。作者在HeLa细胞中使用过氧化氢异丙烯(cumeneOOH)和硫酸铜处理诱导脂质过氧化。观察到AcroB加合物的细胞质保留的时间依赖性增加用PMHC处理后,信号恢复到对照组的水平。表明脂质过氧化水平的升高是抑制MRP介导的LDE加合物输出的原因。
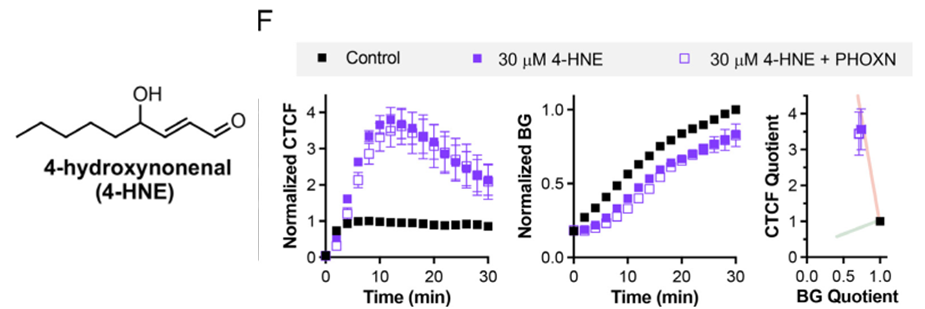
因为MRP1被发现可以在铁死亡过程中被烷基化而受到抑制,作者探索了暴露于烷基化亲电剂是否可以使LDE加合物输出受到抑制。作者发现NEM、DEM、4-HNE三种亲电试剂均可以受到到输出抑制,而4-HNE的抑制效果不能被PHOXN预孵育阻碍,这表明LDEs是铁死亡期间MRP受损的潜在介质。总之,作者通过一系列荧光成像研究,证明了在脂质过氧化发生时,MRP通道蛋白暴露于LDEs发生烷基化,从而在铁死亡过程中被抑制,导致LDEs解毒过程受损。原文链接:https://www.pnas.org/doi/10.1073/pnas.2317616121原文引用:10.1073/pnas.2317616121










目前评论:0